–Ъ–∞–ї–Є–Ї—Б–∞—А–µ–љ—Л
–Ь–∞—В–µ—А–Є–∞–ї –Є–Ј m-protect.ru
–Ъ–∞–ї–Є–Ї—Б–∞—А–µ–љ—Л вАФ —Н—В–Њ –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Є–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П, –њ—А–Њ–і—Г–Ї—В—Л —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Њ–є –Њ–ї–Є–≥–Њ–Љ–µ—А–Є–Ј–∞—Ж–Є–Є —Д–µ–љ–Њ–ї–∞ —Б —Д–Њ—А–Љ–∞–ї—М–і–µ–≥–Є–і–Њ–Љ.–Э–∞–Ј–≤–∞–љ–Є–µ –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ (calixarene), –≤ –њ–µ—А–≤—Л–µ, –±—Л–ї–Њ –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ –Ф–∞–≤–Є–і–Њ–Љ –У—О—В—И–µ (David Gutsche) –Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Њ—В –ї–∞—В–Є–љ—Б–Ї–Њ–≥–Њ —Б–ї–Њ–≤–∞ ¬Ђcalix¬ї –Є–ї–Є ¬Ђchalice¬ї —З–∞—И–∞, —З—В–Њ –Њ—В–Њ–±—А–∞–ґ–∞–µ—В –Њ—Б–Њ–±–µ–љ–љ—Г—О —Д–Њ—А–Љ—Г –Љ–Њ–ї–µ–Ї—Г–ї—Л (—А–Є—Б.1) –Є —Б–ї–Њ–≤–∞ ¬Ђ–∞—А–µ–љ (arene)¬ї —Г–Ї–∞–Ј—Л–≤–∞—О—Й–µ–µ –љ–∞ –∞—А–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–є —Б—В—А–Њ–Є—В–µ–ї—М–љ—Л–є –±–ї–Њ–Ї –і–∞–љ–љ–Њ–≥–Њ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П.
–Т —Б–Њ—Б—В–∞–≤–µ –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є—Е –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤ –Љ–Њ–ґ–љ–Њ –≤—Л–і–µ–ї–Є—В—М –≤–µ—А—Е–љ–Є–є, —Ж–µ–љ—В—А–∞–ї—М–љ—Л–є –Ї–Њ–ї—М—Ж–µ–≤–Њ–є –Њ–±–Њ–і –Є –љ–Є–ґ–љ–Є–є –Њ–±–Њ–і, –Њ–±—А–∞–Ј–Њ–≤–∞–љ–љ—Л–µ —В—А–µ—В-–±—Г—В–Є–ї—М–љ—Л–Љ–Є –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—П–Љ–Є –≤ –њ–∞—А–∞–њ–Њ–ї–Њ–ґ–µ–љ–Є–Є, –∞—А–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –∞—А–µ–љ–Њ–≤—Л–Љ–Є —Д—А–∞–≥–Љ–µ–љ—В–∞–Љ–Є –Є –≥–Є–і—А–Њ–Ї—Б–Є –Є–ї–Є –∞–ї–Ї–Њ–Ї—Б–Є –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—П–Љ–Є –≤ –љ–Є–ґ–љ–µ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Т —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є –і–∞–љ–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ —Д—А–∞–≥–Љ–µ–љ—В—Л —Д–Њ—А–Љ–Є—А—Г—О—В –≤–љ—Г—В—А–µ–љ–љ—О—О –њ–Њ–ї–Њ—Б—В—М –Љ–Њ–ї–µ–Ї—Г–ї—Л –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–∞, –Њ–±—К—С–Љ –Ї–Њ—В–Њ—А–Њ–є –≤ —Б—А–µ–і–љ–µ–Љ —А–∞–≤–µ–љ 10 –Ї—Г–±–Є—З–µ—Б–Ї–Є–Љ –∞–љ–≥—Б—В—А–µ–Љ–∞–Љ.
–Э–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–∞
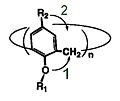
–Т —Б–≤—П–Ј–Є —Б –љ–µ—Г–і–Њ–±—Б—В–≤–Њ–Љ –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А—Л –Ш–Ѓ–Я–Р–Ъ –і–ї—П –љ–∞–Ј–≤–∞–љ–Є—П –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤, —В–∞–Ї –ґ–µ –Ї–∞–Ї –Є –і—А—Г–≥–Є—Е –Њ–±—К–µ–Ї—В–Њ–≤ —Б—Г–њ—А–∞–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є —Е–Є–Љ–Є–Є –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П —В—А–Є–≤–Є–∞–ї—М–љ–∞—П –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–∞, —Г—З–Є—В—Л–≤–∞—О—Й–∞—П –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Б—В—А–Њ–µ–љ–Є—П –Љ–∞–Ї—А–Њ(–≥–µ—В–µ—А–Њ)—Ж–Є–Ї–ї–∞ - –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–∞ –Ф. –У—О—В—И–µ, –≤ –Њ—Б–љ–Њ–≤–µ –Ї–Њ—В–Њ—А–Њ–є –ї–µ–ґ–Є—В –љ–∞–Ј–≤–∞–љ–Є–µ –њ—А–Њ—Б—В–µ–є—И–µ–≥–Њ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—П –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤, –њ–Њ–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 2.–Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–Њ–є –У—О—В—И–µ –і–∞–љ–љ–Њ–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є–є –љ–∞–Ј—Л–≤–∞–µ—В—Б—П 25,26,27,28-—В–µ—В—А–∞–≥–Є–і—А–Њ–Ї—Б–Є–Ї–∞–ї–Є–Ї—Б[4]–∞—А–µ–љ–Њ–Љ, –≥–і–µ —З–Є—Б–ї–Њ –≤ –Ї–≤–∞–і—А–∞—В–љ—Л—Е —Б–Ї–Њ–±–Ї–∞—Е —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ —А–∞–Ј–Љ–µ—А –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–∞, –∞ –њ—А–Є—А–Њ–і–∞ –Є –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї–µ–є –≤ –∞—А–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ —П–і—А–µ —Г—В–Њ—З–љ—П–µ—В—Б—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–Љ–Є —Ж–Є—Д—А–∞–Љ–Є –Є –і–µ—Б–Ї—А–Є–њ—В–Њ—А–∞–Љ–Є. –Э–∞ –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В –љ–∞–Ј–≤–∞–љ–Є–µ –і–∞–љ–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–Њ–є –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А—Л –і–ї—П –Њ–±—И–Є—А–љ–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞ –Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤, —А–µ–Ј–Њ—А—Ж–Є–љ–∞—А–µ–љ–Њ–≤, —В–Є–∞–Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ —З–Є—Б–ї–Њ–Љ –∞—А–µ–љ–Њ–≤—Л—Е —Д—А–∞–≥–Љ–µ–љ—В–Њ–≤.
–Ш—Б—В–Њ—А–Є—П
–Э–∞—З–∞–ї–Њ —А–∞–Ј–≤–Є—В–Є—П —Е–Є–Љ–Є–Є –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤ —Б–≤—П–Ј–∞–љ–Њ —Б –Є–Љ–µ–љ–µ–Љ –љ–µ–Љ–µ—Ж–Ї–Њ–≥–Њ —Г—З–µ–љ–Њ–≥–Њ –Р–і–Њ–ї—М—Д–∞ –§–Њ–љ –С–∞–є–µ—А–∞ (Adolf von Baeyer, 1835 вАУ1917). –Я—А–Њ–≤–µ–і–µ–љ–љ–∞—П –Є–Љ —А–µ–∞–Ї—Ж–Є—П –±–µ–љ–Ј–∞–ї—М–і–Є–≥–Є–і–∞ —Б –њ–Є—А–Њ–≥–∞–ї–ї–Њ–ї–Њ–Љ –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є —Б–Є–ї—М–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л,–њ—А–Є–≤–µ–ї–∞ –Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О –њ–Њ–ї–Є–Љ–µ—А–∞, —Б—В—А—Г–Ї—В—Г—А–∞ –Ї–Њ—В–Њ—А–Њ–≥–Њ —В–∞–Ї –Є –Њ—Б—В–∞–ї–∞—Б—М –љ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–є –≤ —Б–≤—П–Ј–Є —Б –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ –∞–љ–∞–ї–Є—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –≤ —В–Њ –≤—А–µ–Љ—П. –С–∞–є–µ—А–Њ–Љ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–ї–Њ—Б—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –і–∞–љ–љ—Л–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П –Ї–∞–Ї –Ї—А–∞—Б–Є—В–µ–ї–Є –≤ —В–µ–Ї—Б—В–Є–ї—М–љ–Њ–є –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ–Њ—Б—В–Є. –°–ї–µ–і—Г—О—Й–Є–є —И–∞–≥ –≤ —А–∞–Ј–≤–Є—В–Є–Є —Е–Є–Љ–Є–Є –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤ –±—Л–ї —Б–і–µ–ї–∞–љ –±–µ–ї—М–≥–Є–є—Ж–µ–Љ –Ы–µ–Њ –С–∞–Ї–µ–ї–∞–љ–і–Њ–Љ, –Є—Б—Б–ї–µ–і–Њ–≤–∞–≤—И–Є–Љ —А–µ–∞–Ї—Ж–Є—О –Ї–Њ–љ–і–µ–љ—Б–∞—Ж–Є–Є —Д–Њ—А–Љ–∞–ї—М–і–µ–≥–Є–і–∞ —Б —Д–µ–љ–Њ–ї–Њ–Љ, –Ї–Њ—В–Њ—А–∞—П —В–∞–Ї–ґ–µ –њ—А–Є–≤–µ–ї–∞ –Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О –њ–Њ–ї–Є–Љ–µ—А–∞. –Я–µ—А–≤–∞—П –њ–Њ–њ—Л—В–Ї–∞ –Ї–Њ–љ—В—А–Њ–ї—П —А–µ–∞–Ї—Ж–Є–Є –њ–Њ–ї–Є–Љ–µ—А–Є–Ј–∞—Ж–Є–Є –±—Л–ї–∞ –њ—А–Њ–і–µ–ї–∞–љ–∞ –¶–Є–љ–≥–µ –Є –¶–Є–≥–ї–µ—А–Њ–Љ (Alois Zinke –Є Erich Ziegler). –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ—Л–є –Є–Љ–Є –њ–∞—А–∞-—В—А–µ—В-–±—Г—В–Є–ї—Д–µ–љ–Њ–ї, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М –≤ –њ–∞—А–∞- –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є –Є–љ–≥–Є–±–Є—А—Г–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —А–∞–Ј–≤–µ—В–≤–ї–µ–љ–љ—Л—Е –њ–Њ–ї–Є–Љ–µ—А–Њ–≤, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —А–µ–∞–Ї—Ж–Є–Є —Б —Д–Њ—А–Љ–∞–ї—М–і–µ–≥–Є–і–Њ–Љ –≤ –ї—М–љ—П–љ–Њ–Љ –Љ–∞—Б–ї–µ –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є NaOH –Њ–±—А–∞–Ј—Г–µ—В –ї–Є–љ–µ–є–љ—Л–є –њ–Њ–ї–Є–Љ–µ—А. –Т —В–Њ—В –ґ–µ –≥–Њ–і –Э–Є–µ–і–µ—А–ї –Є –§–Њ–≥–µ–ї—М (Niederl, Vogel) –њ—А–Њ–≤–µ–і—П —А–µ–∞–Ї—Ж–Є—О –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤ —В–µ—Е –ґ–µ —Г—Б–ї–Њ–≤–Є—П—Е –љ–Њ, –Є—Б–њ–Њ–ї—М–Ј—Г—П –≤–Љ–µ—Б—В–Њ —Д–µ–љ–Њ–ї–∞ –Ј–∞–Љ–µ—Й–µ–љ–љ—Л–є —А–µ–Ј–Њ—А—Ж–Є–љ–Њ–ї, —Б–Љ–Њ–≥–ї–Є –і–Њ–±–Є—В—М—Б—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —В–µ—В—А–∞–Љ–µ—А–∞, –±—Г–і—Г—Й–µ–≥–Њ –Ї–∞–ї–Є–Ї—Б[4]—А–µ–Ј–Њ—А—Ж–Є–љ–∞—А–µ–љ–∞, —З—В–Њ —П–≤–ї—П–ї–Њ—Б—М –љ–∞—Б—В–Њ—П—Й–Є–Љ –њ—А–Њ—А—Л–≤–Њ–Љ –≤ —А–∞–Ј–≤–Є—В–Є–Є —Е–Є–Љ–Є–Є –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤. –Ф. –Ъ–Њ—А–љ—Д–Њ—А—В (John Cornforth) –≤ 1955 –≥–Њ–і—Г –±—Л–ї –Њ–і–љ–Є–Љ –Є–Ј –њ–µ—А–≤—Л—Е –Ї—В–Њ –Њ—Б–Њ–Ј–љ–∞–ї –њ–Њ—В–µ–љ—Ж–Є–∞–ї –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤ –Ї–∞–Ї —З–∞—И–µ-–њ–Њ–і–Њ–±–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є, –∞–љ–∞–ї–Њ–≥–Њ–≤ —Д–µ—А–Љ–µ–љ—В–Њ–≤ –Є –њ–Њ–≤—В–Њ—А–Є–≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В—Л –¶–Є–љ–≥–µ –Є –¶–Є–≥–ї–µ—А–∞, –і–Њ–Ї–∞–Ј–∞–ї —З—В–Њ –і–∞–љ–љ–∞—П —Б–Љ–µ—Б—М —Б–Њ–і–µ—А–ґ–Є—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤.
–°–Є–љ—В–µ–Ј
–Т–њ–µ—А–≤—Л–µ –њ–Њ–ї—Г—З–Є—В—М —Н—В–Є —Б–Њ–µ–і–Є–љ–µ–љ–Є—П –Љ–µ—В–Њ–і–Њ–Љ —Б—В—Г–њ–µ–љ—З–∞—В–Њ–є —Ж–Є–Ї–ї–Є–Ј–∞—Ж–Є–Є —Г–і–∞–ї–Њ—Б—М –≤ 1956 –≥–Њ–і—Г –≥—А—Г–њ–њ–µ –•–∞–љ—В–µ—А–∞. –Ь–µ—В–Њ–і–Њ–Љ –њ–Њ—Б—В–∞–і–Є–є–љ–Њ–є –Ї–Њ–љ–і–µ–љ—Б–∞—Ж–Є–Є 2-–±—А–Њ–Љ-4-–∞–ї–Ї–Є–ї–Ј–∞–Љ–µ—Й–µ–љ–љ—Л—Е —Д–µ–љ–Њ–ї–Њ–≤ –≤ –±–Є—Б—Д–µ–љ–Њ–ї—М–љ–Њ–µ –њ—А–Њ–Є–Ј–≤–Њ–і–љ–Њ–µ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –ї–Є–љ–µ–є–љ—Л–µ –Њ–ї–Є–≥–Њ–Љ–µ—А—Л —Б —В—А–µ–Љ—П –Є —З–µ—В—Л—А—М–Љ—П —Д–µ–љ–Њ–ї—М–љ—Л–Љ–Є —Д—А–∞–≥–Љ–µ–љ—В–∞–Љ–Є. –Я–Њ—Б–ї–µ –і–µ–±—А–Њ–Љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –њ–Њ—Б–ї–µ–і–љ–µ–є —Б—В–∞–і–Є–Є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –≤–љ—Г—В—А–Є–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є —Ж–Є–Ї–ї–Є–Ј–∞—Ж–Є–Є –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ –њ—А–Њ–Є–Ј–≤–Њ–і–љ–Њ–µ, –Є–Љ–µ–≤—И–µ–µ –≤ —Б–≤–Њ—С–Љ —Б–Њ—Б—В–∞–≤–µ —З–µ—В—Л—А–µ –∞—А–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е —Д—А–∞–≥–Љ–µ–љ—В–∞. –Я–Њ–і–Њ–±–љ–∞—П –Љ–µ—В–Њ–і–Є–Ї–∞ —Б–Є–љ—В–µ–Ј–∞ –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–∞ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –±—Л–ї–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–∞ —В–∞–Ї –ґ–µ –Ъ–∞–Љ–Љ–µ—А–µ—А–Њ–Љ —Б —Б–Њ—В—А. –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –і—А—Г–≥–Є—Е –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤.
–°—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ –Љ–µ—В–Њ–і–Њ–≤ —Б—В—Г–њ–µ–љ—З–∞—В–Њ–є —Ж–Є–Ї–ї–Є–Ј–∞—Ж–Є–Є —П–≤–ї—П–ї—Б—П –љ–Є–Ј–Ї–Є–є (5-30%, –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —А–∞–Ј–Љ–µ—А–∞ –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–∞) –≤—Л—Е–Њ–і –Ї–Њ–љ–µ—З–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤. –Я–Њ–≤—Л—И–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–µ–∞–Ї—Ж–Є–є —Ж–Є–Ї–ї–Є–Ј–∞—Ж–Є–Є —Б—В–∞–ї–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –±–ї–∞–≥–Њ–і–∞—А—П —А–∞–±–Њ—В–∞–Љ –≥—А—Г–њ–њ—Л –Ф. –У—О—В—И–µ, –≤ –Ї–Њ—В–Њ—А—Л—Е —Б–Є–љ—В–µ–Ј —В—А–µ—В-–±—Г—В–Є–ї–Ї–∞–ї–Є–Ї—Б[4,6,8]–∞—А–µ–љ–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї—Б—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —В–µ–Љ–њ–ї–∞—В–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Є –њ—А–Є–≤—С–ї –Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–Њ–≤ —Б –≤—Л—Б–Њ–Ї–Є–Љ–Є (50-82%) –≤—Л—Е–Њ–і–∞–Љ–Є. –Ш–Ј —В–∞–±–ї–Є—Ж—Л —Б–ї–µ–і—Г–µ—В, —З—В–Њ —А–µ–Ј—Г–ї—М—В–∞—В —А–µ–∞–Ї—Ж–Є–Є —Ж–Є–Ї–ї–Є–Ј–∞—Ж–Є–Є –Ј–∞–≤–Є—Б–Є—В –Њ—В —А–∞–Ј–Љ–µ—А–∞ –Ї–∞—В–Є–Њ–љ–∞ —Й–µ–ї–Њ—З–љ–Њ–≥–Њ –Љ–µ—В–∞–ї–ї–∞, –≥–Є–і—А–Њ–Ї—Б–Є–і –Ї–Њ—В–Њ—А–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –Ї–∞–Ї –Њ—Б–љ–Њ–≤–∞, –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –њ—А–Њ—В–µ–Ї–∞–љ–Є—П —А–µ–∞–Ї—Ж–Є–Є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —В—А–µ—В-–±—Г—В–Є–ї–Ї–∞–ї–Є–Ї—Б[8]–∞—А–µ–љ —Н—В–Њ –њ—А–Њ–і—Г–Ї—В –Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П, —В—А–µ—В-–±—Г—В–Є–ї–Ї–∞–ї–Є–Ї—Б[4]–∞—А–µ–љ вАУ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ, –∞ —В—А–µ—В.-–±—Г—В–Є–ї–Ї–∞–ї–Є–Ї—Б[6]–∞—А–µ–љ вАУ —В–µ–Љ–њ–ї–∞—В–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П, —В–Њ –µ—Б—В—М –њ–Њ–ї—Г—З–∞–µ—В—Б—П –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –≤ —Б–ї—Г—З–∞–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ъ–Ю–Э –Є–ї–Є RbOH. –Ґ–µ–Љ–њ–ї–∞—В–љ—Л–є —Н—Д—Д–µ–Ї—В –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В —З–µ—В–Ї–Њ–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–µ –Љ–µ–ґ–і—Г —А–∞–Ј–Љ–µ—А–∞–Љ–Є –Ї–∞—В–Є–Њ–љ–∞ —Й–µ–ї–Њ—З–љ–Њ–≥–Њ –Љ–µ—В–∞–ї–ї–∞ –Є —А–∞–Ј–Љ–µ—А–∞–Љ–Є –Њ–±—А–∞–Ј—Г—О—Й–µ–≥–Њ—Б—П –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–∞. –Я–Њ—Б–ї–µ–і—Г—О—Й–Є–µ –Є–Ј—Г—З–µ–љ–Є–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤ (–∞–ї–Ї–Њ–Ї—Б–Є)–Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤ —Б –Є–Њ–љ–∞–Љ–Є —Й–µ–ї–Њ—З–љ—Л—Е –Є —Й–µ–ї–Њ—З–љ–Њ–Ј–µ–Љ–µ–ї—М–љ—Л—Е –Љ–µ—В–∞–ї–ї–Њ–≤ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –≤—Л—П–≤–Є—В—М —А—П–і —Г—Б–ї–Њ–≤–Є–є –і–ї—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –њ—А–Њ—З–љ—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤ —В–∞–Ї–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞, –Ї –Ї–Њ—В–Њ—А—Л–Љ –Њ—В–љ–Њ—Б—П—В—Б—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–µ —А–∞–Ј–Љ–µ—А–Њ–≤ –Є–Њ–љ–∞ –Љ–µ—В–∞–ї–ї–∞ –Є –њ–Њ–ї–Њ—Б—В–Є –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–∞, –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ–Њ–µ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –∞—В–Њ–Љ–Њ–≤ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –≤ –љ–Є–ґ–љ–µ–Љ –Њ–±–Њ–і–µ –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–∞, –Є –Ј–∞—А—П–і –Є–Њ–љ–∞ –Љ–µ—В–∞–ї–ї–∞. –Т –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В –Є–Ј–≤–µ—Б—В–µ–љ –њ–Њ–і—Е–Њ–і –Ї —Б–Є–љ—В–µ–Ј—Г —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ–Њ–≥–Њ —З–Є—Б–ї–∞ –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Љ–Њ—Б—В–Є–Ї–Њ–≤—Л–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є (–°, S, Se) –Є —А–∞–Ј–ї–Є—З–љ—Л–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –Њ—В 3 –і–Њ 20 —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –±–ї–Њ–Ї–Њ–≤ (–∞—А–µ–љ–Њ–≤—Л—Е —Д—А–∞–≥–Љ–µ–љ—В–Њ–≤). –Э–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —Б—В–Њ–ї—М –Њ–≥—А–Њ–Љ–љ–Њ–µ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–Є–µ –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є –≤–Ї–ї—О—З–∞—П –Ї–∞–ї–Є–Ї—Б—А–µ–Ј–Њ—А—Ж–Є–љ–∞—А–µ–љ—Л, –љ–∞–Є–±–Њ–ї—М—И–µ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–∞–Ї –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –њ–Њ–ї—Г—З–Є–ї–Є –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤—Л–µ –Є —В–Є–∞–Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤—Л–µ –њ–ї–∞—В—Д–Њ—А–Љ—Л —Б 4,6, –Є –≤ —А–µ–і–Ї–Є—Е —Б–ї—Г—З–∞—П—Е —Б 8 –∞—А–µ–љ–Њ–≤—Л–Љ–Є —Д—А–∞–≥–Љ–µ–љ—В–∞–Љ–Є.
–°—В–µ—А–µ–Њ—Е–Є–Љ–Є—П
–Ъ–∞–ї–Є–Ї—Б–∞—А–µ–љ—Л –Љ–Њ–≥—Г—В —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞—В—М –≤–Њ –Љ–љ–Њ–ґ–µ—Б—В–≤–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є–є –Ј–∞ —Б—З–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –і–≤—Г—Е —В–Є–њ–Њ–≤ –Є–љ–≤–µ—А—Б–Є–Є –Ї–Є—Б–ї–Њ—А–Њ–і-—З–µ—А–µ–Ј-—Ж–µ–љ—В—А–∞–ї—М–љ—Л–є-–Њ–±–Њ–і (oxygen-through-annulus) –Є –њ–∞—А–∞-–Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М-—З–µ—А–µ–Ј-—Ж–µ–љ—В—А–∞–ї—М–љ—Л–є-–Њ–±–Њ–і (para-substituent-through-annulus) (—А–Є—Б. 3). –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —В—А–∞–љ—Б–∞–љ—Г–ї—П—А–љ–Њ–µ –≤—А–∞—Й–µ–љ–Є–µ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ —В–Њ–ї—М–Ї–Њ –Ј–∞ —Б—З–µ—В –≤–≤–µ–і–µ–љ–Є—П –Њ–±—К–µ–Љ–љ—Л—Е –≥—А—Г–њ–њ, –Ї–∞–Ї –≤ –љ–Є–ґ–љ–Є–є –Њ–±–Њ–і –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–∞, —В–∞–Ї –Є –≤ –њ–∞—А–∞ - –њ–Њ–ї–Њ–ґ–µ–љ–Є—П—Е –∞—А–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–ї–µ—Ж (–≤–µ—А—Е–љ–Є–є –Њ–±–Њ–і).
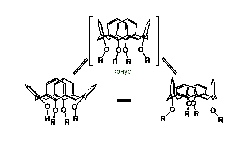
–Я—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ –Ї–∞–ї–Є–Ї—Б[4]–∞—А–µ–љ–Њ–≤ –Є —В–Є–∞–Ї–∞–ї–Є–Ї—Б[4]–∞—А–µ–љ–Њ–≤ –Љ–Њ–≥—Г—В –љ–∞—Е–Њ–і–Є—В—М—Б—П –≤ —З–µ—В—Л—А–µ—Е –Њ—Б–љ–Њ–≤–љ—Л—Е –Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є—П—Е (—А–Є—Б.1) –Ї–Њ–љ—Г—Б (–∞), –њ–∞—А—Ж–Є–∞–ї—М–љ–Є–є –Ї–Њ–љ—Г—Б (b), 1,2-–∞–ї—М—В–µ—А–љ–∞—В (c), –Є 1,3-–∞–ї—М—В–µ—А–љ–∞—В (d) (—А–Є—Б.4), –Ї–Њ—В–Њ—А—Л–µ –Њ—В–ї–Є—З–∞—О—В—Б—П –≤–Ј–∞–Є–Љ–љ—Л–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ–Љ –∞—А–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е —Д—А–∞–≥–Љ–µ–љ—В–Њ–≤ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –≥–ї–∞–≤–љ–Њ–є –њ–ї–Њ—Б–Ї–Њ—Б—В–Є –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–∞, –Ї–Њ—В–Њ—А–∞—П —Г—Б–ї–Њ–≤–љ–Њ –њ—А–Њ—Е–Њ–і–Є—В –њ–Њ –Љ–µ—В–Є–ї–µ–љ–Њ–≤—Л–Љ —Б–≤—П–Ј–Ї–∞–Љ. –°–ї–µ–і—Г–µ—В –≤—Л–і–µ–ї—П—В—М –Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є–Њ–љ–љ–Њ –Љ–Њ–±–Є–ї—М–љ—Л–µ –Є –Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є–Њ–љ–љ–Њ –ґ–µ—Б—В–Ї–Є–µ –Њ—Б—В–Њ–≤—Л –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤, —В–Њ –µ—Б—В—М –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ—Л –≤ –Ї–Њ—В–Њ—А—Л—Е –≤–Њ–Ј–Љ–Њ–ґ–љ—Л –Є–ї–Є –љ–µ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л –њ–µ—А–µ—Е–Њ–і—Л –Љ–µ–ґ–і—Г –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є—П–Љ.
–†–∞—Б—З–µ—В—Л –њ–Њ –Љ–µ—В–Њ–і–∞–Љ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–µ—Е–∞–љ–Є–Ї–Є –≤–Љ–µ—Б—В–µ —Б –Љ–µ—В–Њ–і–Њ–Љ –ѓ–Ь–† (1H, 13C) –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –і–ї—П –Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Ї–Њ–љ—Г—Б –≤ —А–∞—Б—В–≤–Њ—А–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –±—Л—Б—В—А—Л–є –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–є –њ–µ—А–µ—Е–Њ–і —Г–њ–ї–Њ—Й–µ–љ–љ—Л–є –Ї–Њ–љ—Г—Б-—Г–њ–ї–Њ—Й–µ–љ–љ—Л–є –Ї–Њ–љ—Г—Б (—А–Є—Б.5), –Ј–∞ —Б—З–µ—В –њ–µ—А–µ—Е–Њ–і–∞ –і–≤—Г—Е –≤–µ—А—В–Є–Ї–∞–ї—М–љ–Њ –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞–љ–љ—Л—Е –∞—А–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е —Д—А–∞–≥–Љ–µ–љ—В–Њ–≤ –≤ –љ–∞–Ї–ї–Њ–љ–љ–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є—П, –∞ –і–≤—Г—Е –і—А—Г–≥–Є—Е - –Є–Ј –љ–∞–Ї–ї–Њ–љ–љ–Њ–≥–Њ –њ–Њ–ї–Њ–ґ–µ–љ–Є—П –≤ –≤–µ—А—В–Є–Ї–∞–ї—М–љ–Њ–µ. –Я–Њ—Н—В–Њ–Љ—Г –≤ —А–∞—Б—В–≤–Њ—А–µ –≤—Б–µ —З–µ—В—Л—А–µ –∞—А–µ–љ–Њ–≤—Л—Е —Д—А–∞–≥–Љ–µ–љ—В–∞ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ—Л, –і–∞–љ–љ—Л–є —Д–∞–Ї—В –љ–∞–±–ї—О–і–∞–µ—В—Б—П —В–∞–Ї –ґ–µ –і–ї—П –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤ —Б –±–Њ–ї—М—И–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е —Д—А–∞–≥–Љ–µ–љ—В–Њ–≤.
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ
–С–ї–∞–≥–Њ–і–∞—А—П –Њ–њ–Є—Б–∞–љ–љ—Л–Љ –≤ –і–∞–љ–љ–Њ–є —Б—В–∞—В—М–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞–Љ, –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ—Л –љ–∞—Е–Њ–і—П—В —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—В—А–∞—Б–ї—П—Е –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ–Њ—Б—В–Є. –Ґ–∞–Ї –≤ –∞–љ–∞–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —Е–Є–Љ–Є–Є –љ–∞ –Њ—Б–љ–Њ–≤–µ –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤—Л—Е –њ–ї–∞—В—Д–Њ—А–Љ —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ—Л —А–µ—Ж–µ–њ—В–Њ—А—Л –і–ї—П —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Є/–Є–ї–Є –≥—А—Г–њ–њ–Њ–≤–Њ–≥–Њ –Є–Ј–≤–ї–µ—З–µ–љ–Є—П –Є–Њ–љ–Њ–≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–µ—В–∞–ї–ї–Њ–≤: —Й–µ–ї–Њ—З–љ—Л—Е –Љ–µ—В–∞–ї–ї–Њ–≤ (Na(I), K(I), Cs(I), Li(I)), —Й–µ–ї–Њ—З–љ–Њ–Ј–µ–Љ–µ–ї—М–љ—Л—Е –Љ–µ—В–∞–ї–ї–Њ–≤ (Ca(II), Mg(II)) –Є –њ–µ—А–µ—Е–Њ–і–љ—Л—Е –Љ–µ—В–∞–ї–ї–Њ–≤ (Ag(I), Pd(II), Au(III), Hg(II)). –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–≥–Њ —А–∞—Б–њ–Њ–Ј–љ–∞–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–∞–Ј—А–∞–±–Њ—В–∞—В—М –Ї–∞—В–∞–ї–Є–Ј–∞—В–Њ—А—Л –љ–∞ –Њ—Б–љ–Њ–≤–µ –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Є—Е –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤—Л—Е –њ–ї–∞—В—Д–Њ—А–Љ, –і–ї—П –Ї–Њ—В–Њ—А—Л—Е –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Љ–µ–ґ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–Љ–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П–Љ–Є —Б—Г–±—Б—В—А–∞—В- –Ї–∞—В–∞–ї–Є–Ј–∞—В–Њ—А . –Я—А–Є —Н—В–Њ–Љ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Є–µ –Ї–∞—В–∞–ї–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–Є—Б—В–µ–Љ, –≤–Ї–ї—О—З–∞—О—Й–Є—Е –љ–µ–Ї–Њ–Њ—А–і–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –Љ–∞–Ї—А–Њ—Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Є–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –≤—Л—Б—В—Г–њ–∞—О—Й–Є–µ, –≤ –Ї–∞—З–µ—Б—В–≤–µ ¬Ђ–Љ–Є–Ї—А–Њ—А–µ–∞–Ї—В–Њ—А–Њ–≤¬ї —Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г—О—Й–Є—Е –њ–µ—А–µ—Е–Њ–і–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —А–µ–∞–Ї—Ж–Є–Є –Є–ї–Є –≤–ї–Є—П—О—Й–µ–≥–Њ –љ–∞ —А–µ–≥–Є–Њ- –Є —Б—В–µ—А–µ–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—Ж–µ—Б—Б–∞ –Ј–∞ —Б—З–µ—В —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –Њ—А–Є–µ–љ—В–∞—Ж–Є–Є —Б—Г–±—Б—В—А–∞—В–∞. –Ю—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –њ—А–Є–≤–ї–µ–Ї–∞—О—В –Ї–∞—В–∞–ї–Є–Ј–∞—В–Њ—А—Л –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є–Љ —Ж–µ–љ—В—А–Њ–Љ –Є –ї–Є–≥–∞–љ–і–Њ–Љ, –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б—Г–±—Б—В—А–∞—В–∞ –њ–Њ–ї–Њ—Б—В—М—О –ї–Є–≥–∞–љ–і–∞-—А–µ—Ж–µ–њ—В–Њ—А–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В –µ–≥–Њ –Њ—А–Є–µ–љ—В–∞—Ж–Є—О –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Њ–Љ—Г —Ж–µ–љ—В—А—Г, —З—В–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–ї–Є—П–µ—В –љ–∞ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Є —Б—Г–±—Б—В—А–∞—В–љ—Г—О —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —А–µ–∞–Ї—Ж–Є–Є. –Т –≥–Њ–Љ–Њ–≥–µ–љ–љ–Њ–Љ –Ї–∞—В–∞–ї–Є–Ј–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Б–µ—А–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ–Њ–≤ —Б –Ј–Њ–ї–Њ—В–Њ–Љ –і–ї—П –Ї–∞—В–∞–ї–Є—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–Ї–Є—Б–ї–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –≤—А–µ–і–љ—Л—Е —Б—Г–ї—М—Д–Є–і–Њ–≤, –љ–∞–њ—А–Є–Љ–µ—А –≥–Њ—А—З–Є—З–љ–Њ–≥–Њ –≥–∞–Ј–∞, –≤ –Љ—П–≥–Ї–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е. –Т –±–Є–Њ—Е–Є–Љ–Є–Є –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ—Л –љ–∞—Е–Њ–і—П—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ї–∞–Ї —Б–Њ–µ–і–Є–љ–µ–љ–Є—П –∞–љ–∞–ї–Њ–≥–Є —Д–µ—А–Љ–µ–љ—В–Њ–≤, —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ—В–Њ—А—Л—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П —Б–ї–Њ–ґ–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤. –Ґ–∞–Ї —В–µ—В—А–∞–Љ–µ—В–Њ–Ї—Б–Є(—В–Є–∞)–Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ –Љ–Њ–ґ–µ—В –≤—Л—Б—В—Г–њ–∞—В—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–љ–∞–ї–Њ–≥–∞ –±–µ–ї–Ї–∞ –∞–Ї–≤–Њ–њ–Њ—А–Є–љ–∞, –і–ї—П –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ —В—А–∞–љ—Б–њ–Њ—А—В–∞ –≤–Њ–і—Л —З–µ—А–µ–Ј –Ї–ї–µ—В–Њ—З–љ—Г—О –Љ–µ–Љ–±—А–∞–љ—Г.–Т —В–≤–µ—А–і–Њ–є —Д–∞–Ј–µ –Ї–∞–ї–Є–Ї—Б–∞—А–µ–љ—Л –љ–∞—Е–Њ–і—П—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –±–Є—Б–ї–Њ–Є—Б—В—Л—Е —Б—В—А—Г–Ї—В—Г—А —Б –Њ—А–Є–µ–љ—В–∞—Ж–Є–µ–є –Љ–Њ–ї–µ–Ї—Г–ї –≥–Њ–ї–Њ–≤–∞ –Ї –≥–Њ–ї–Њ–≤–µ, –Њ–±—А–∞–Ј—Г—О –≤–љ—Г—В—А–µ–љ–љ—О—О –њ–Њ–ї–Њ—Б—В—М —Б–њ–Њ—Б–Њ–±–љ—Г—О –≤–Ї–ї—О—З–∞—В—М –Љ–Њ–ї–µ–Ї—Г–ї—Л –≥–Њ—Б—В–µ–є —Б—В—А–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ —А–∞–Ј–Љ–µ—А–∞. –≠—В–≤—Г–і–Њ–Љ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –і–∞–љ–љ—Л–µ –Ї—А–Є—Б—В–∞–ї–ї–Є—З–µ—Б–Ї–Є–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П –Љ–Њ–≥—Г—В –∞–±—Б–Њ—А–±–Є—А–Њ–≤–∞—В—М –і–Є–Њ–Ї—Б–Є–і —Г–≥–ї–µ—А–Њ–і–∞ –Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –∞–±—Б–Њ—А–±–Є—А—Г—О—В –≤–Њ–і–Њ—А–Њ–і, —З—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Њ –і–ї—П –Њ—З–Є—Й–µ–љ–Є—П –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –њ—А–Є —А–Є—Д–Њ—А–Љ–Є–љ–≥–µ –і–ї—П –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤–Њ–і–Њ—А–Њ–і–∞ –≤ —В–Њ–њ–ї–Є–≤–љ–Њ–Љ —Н–ї–µ–Љ–µ–љ—В–µ.
![–†–Є—Б.1 –Ъ–∞–ї–Є–Ї—Б[4]–∞—А–µ–љ—Л - —З–∞—И–µ–њ–Њ–і–Њ–±–љ—Л–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П](/wiki/images/thumb/5/5d/Calixarene-1.jpg/280px-Calixarene-1.jpg)
![–†–Є—Б.2 –°—Е–µ–Љ–∞—В–Є—З–љ–Њ–µ –Њ—В–Њ–±—А–∞–ґ–µ–љ–Є–µ –Ї–∞–ї–Є–Ї—Б[4]–∞—А–µ–љ–Њ–≤](/wiki/images/thumb/f/f4/Calixarene-scheme.jpg/280px-Calixarene-scheme.jpg)
![–†–Є—Б.4 –Ю—Б–љ–Њ–≤–љ—Л–µ –Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Ї–∞–ї–Є–Ї—Б[4]–∞—А–µ–љ–Њ–≤](/wiki/images/thumb/f/f7/Calixarene-conformation.jpg/300px-Calixarene-conformation.jpg)